گلیوبلاستوما یک بدخیمی تهاجمی است و حدود 15 درصد از کل تومورهای مغزی را شامل میشود. حتی زمانی که این سرطان در ابتدا با درمان کنترل میشود، در اغلب موارد مجدداً عود میکند. جراحی و رادیوتراپی میتوانند چند ماه طول عمر را افزایش دهند، اما سرطان مغز معمولاً در عرض یک تا دو سال پس از تشخیص به زندگی بیمار پایان میدهد و کمتر از پنج درصد افراد بیش از پنج سال زنده میمانند. همانند گلیوبلاستوما، درمان بسیاری از سرطانهای دیگر ناحیه جمجمه نیز به دلیل ماهیت حساس بافت طبیعی مغز و آسیب پذیری آن نسبت به جراحی و رادیوتراپی، بسیار چالش برانگیز است. امّا، اکنون وضعیت درمان این بیماریها به لطف روشهای جدید و شتاب دهنده هایی که منابع قدرتمند نوترونی ایجاد میکنند، رو به تغییر است.
ایان سواینسون، فیزیکدان هستهای در آژانس بین المللی انرژی اتمی (IAEA)، میگوید: وقتی به انجام واکنشهای هستهای فکر میکنید، احتمالاً تصور نمیکنید که سر انسان بهترین مکان برای انجام آن باشد، اما اشتباه میکنید! او با IAEA در مورد توسعه برنامههای شتاب دهنده برای تولید نوترون، از جمله در حیطه پزشکی همکاری میکند. به گفته وی استفاده از این فناوری به ویژه در یکی از درمانهای سرطان یعنی درمان با گیراندازی نوترون بور (BNCT) بسیار امیدوارکننده است. اصابت نوترونها به اتمهای بور در برخی از انواع سرطانهای مغز، سر و گردن میتواند نجاتبخش جان انسانها باشد.
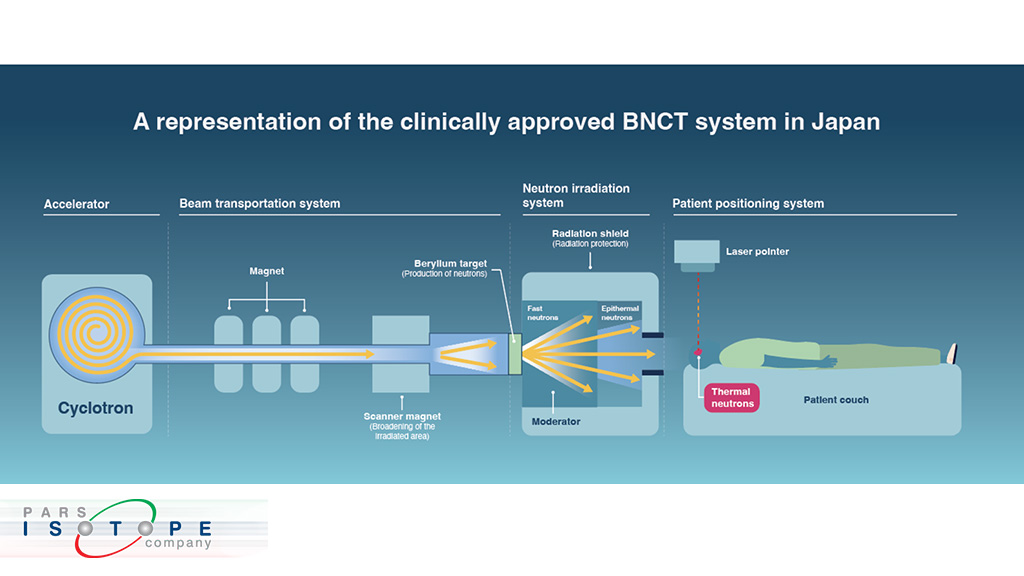
در BNCT از قدرت تخریبی نوترونها استفاده میشود و در آن تا حد امکان از تکنیک آسیب موضعی به سلولهای تومور بهره گرفته میشود. مهار توانایی تخریب نوترونها با ایزوتوپهای بور-10 امکان پذیر است. بور-10 غیر رادیواکتیو است و در گیراندازی نوترون عالی عمل میکند. در نتیجه، یک واکنش هستهای در یک مکان خاص انجام میشود و بور به دو قطعه پرانرژی شکسته میشود. بنابراین، میتوان با تزریق داروهای ویژهای که بور-10 را به محل تومور میرسانند، برای درمان بیمار اقدام نمود.
هنوز BNCT به طور گسترده در دسترس نیست و استفاده از آن بیشتر جنبه آزمایشی دارد. اما اوضاع در حال تغییر است. در سال 2020، دو مرکز BNCT برای درمانهای بالینی در کوریاما و اوزاکا در ژاپن آغاز به کار کردند. در همان سال، IAEA و دانشگاه اوکایاما در ژاپن توافق کردند که همکاری خود در زمینه BNCT را از طریق برگزاری رویدادها، تبادل دانش و اطلاعات و توسعه پایگاه دادهها، گسترش دهند.
هیروفومی ماکینو، رئیس دانشگاه اوکایاما، در آن زمان گفت : BNCT یک روش پیشرفته درمان سرطان محسوب میشود که از بهم پیوستن فیزیک هستهای مدرن و زیست شناسی سلولی دارویی حاصل شده است. با این حال، ما نباید سابقه طولانی مبارزه و تلاش برای توسعه این فناوری دشوار پزشکی را فراموش کنیم.
در سال 2001، آژانس بین المللی انرژی اتمی یک گزارش فنی در مورد BNCT تهیه کرد که به یک مرجع برای این حوزه تبدیل شد. در آن زمان، تنها منابع نوترونی قابل استفاده راکتورهای تحقیقاتی بودند. از آن زمان، نسل جدیدی از منابع نوترونی مبتنی بر شتاب دهنده فشرده توسعه یافته است که میتواند مستقیماً در کلینیکها نصب شود. این مهم منجر به بازگشت توجه و افزایش علاقمندی بهBNCT شده است.
پروژههای BNCT در آرژانتین، چین، فنلاند و جمهوری کره نیز در حال پیگیری است. سواینسون افزود: 20 سال پیش، استفاده از نوترونهای شتاب دهندهها برای درمان سرطان تنها یک نظریه بود. امّا این نظریه اکنون به واقعیت پیوسته است و این پیشرفت در آینده در یک سند فنی IAEA تحت عنوان پیشرفت ها در درمان با گیراندازی نوترون بور منعکس خواهد شد.
تحول سیکلوترونها
تشخیص امکان استفاده از BNCT برای یک بیمار، نیازمند تزریق یک ترکیب بور نشاندار شده با فلوئور-18 (F-18) است که بوسیله سیکلوترون تولید میشود و به دنبال آن تصویربرداری از بیمار با استفاده از تکنیک پزشکی هستهای PET-CT، انجام میشود. ترکیب نشاندار شده با 18F-، 4-borono-2-F-18-fluoro-phenylalanine یا FBPA نامیده می شود. FBPA مهم است زیرا به پزشکان نشان میدهد که یک تومور، ترکیبی حاوی بور را جذب کرده و برای BNCT آماده است. بدون آن، درمان ممکن است کارساز نباشد. امیررضا جلیلیان، شیمیدان در حوزه رادیودارو و رادیوایزوتوپها در آژانس بین المللی انرژی اتمی، گفت: از آنجایی که استفاده از BNCT رو به گسترش است، ما برای پاسخگویی به تقاضای FBPA، به سیکلوترونها نیاز خواهیم داشت. سیکلوترون نوعی شتاب دهنده ذرات است که با شلیک پرتو ذرات به ایزوتوپهای پایدار، رادیوایزوتوپهای مورد استفاده در پزشکی هستهای را تولید میکند. این برهمکنش منجر به یک واکنش هستهای میشود که رادیو ایزوتوپهایی با نیمه عمر کوتاه را ایجاد میکند. از آنجایی که این رادیو ایزوتوپها به سرعت تجزیه میشوند، باید در نزدیکی یا در محلی که درمان انجام میشود تولید شوند و فوراً مورد استفاده قرار گیرند.
جلیلیان خاطرنشان کرد که اگرچه تعداد راکتورهای تحقیقاتی مورد استفاده برای تولید رادیو ایزوتوپها تقریباً ثابت است، سیکلوترونهای جدید، همه کاره و مقرون به صرفه در سراسر جهان در حال گسترش هستند. بسیاری از رادیو ایزوتوپهای دارای نیمه عمر کوتاه، مورد استفاده برای بیماران را میتوان توسط سیکلوترونها در بیمارستانها تولید کرد و این یک مزیت بزرگ برای این فناوری است.
رادیوداروی فلورودوکسی گلوکز یا همان FDG که مبتنی بر F-18 میباشد، تنها یک نمونه از رادیوداروهایی است که بوسیله سیکلوترون قابل تولید هستند. این ردیاب رادیویی در حدود 95 درصد از تصویربرداریهای PET-CT استفاده میشود و برای انجام تصویربرداریهای تشخیصی مغز و انواع سرطان حیاتی است.
یک عامل رادیودارویی مهم دیگر گالیم-68 (68Ga-) است که جزء کلیدی برخی از رادیوداروهای ترانوستیک بشمار میرود، نوعی رادیودارو که هم برای تشخیص و هم برای درمان استفاده میشود. این گونه رادیوداروها نقش مهمی در تشخیص و پیگیری سرطان ها ایفا میکنند و به ویژه در مورد سرطان پروستات بسیار نوید بخشند. با این حال، تولید 68Ga- تا حدی چالش برانگیز است.
امروزه رایج ترین روش برای تولید 68Ga- استفاده از یک سیستم غیر شتاب دهنده به نام ژنراتور است، امّا ممکن است ژنراتورها نتوانند به سادگی پاسخگوی تقاضای مراکز برای دستیابی به Ga-68 باشند. سیکلوترونها یک ابزار جایگزین موثر برای تولید مستقیم این رادیوایزوتوپ بشمار میروند و امکان دسترسی به Ga-68 را تا حد زیادی افزایش می دهند. IAEA در حال حاضر در حال هماهنگی یک پروژه تحقیقاتی برای حمایت از تبادل مسائل تخصصی در خصوص تولید Ga-68 بر پایه سیکلوترون در سطح بین المللی است و در سال 2019 سندی را با عنوان Gallium-68 Cyclotron Production منتشر کرد که به این موضوع اختصاص دارد.
منبع: IAEA